 Mañana tendremos ocasión de contarles a nuestros compañeros del Distrito Sanitario Costa del Sol que Twitter, además de una excelente fuente de información, es un estupendo repositorio que permite, de múltiples formas, guardar y lo que es más importante, tener a mano, aquello que previamente hemos seleccionado para cuando lo necesitemos. Un buen ejemplo de lo que estamos diciendo es el post de hoy, en el que vamos a intentar aclarar algunos conceptos básicos en relación a los fármacos biosimilares, algunos de los cuales están llamando ya a nuestra puerta. Así que, para la ocasión hemos tirado del archivo tuitero y con este magnífica revisión de Belén Calabozo como guía, os presentamos lo que pretende ser un didáctico juego de preguntas y respuestas sobre este polémico asunto…
Mañana tendremos ocasión de contarles a nuestros compañeros del Distrito Sanitario Costa del Sol que Twitter, además de una excelente fuente de información, es un estupendo repositorio que permite, de múltiples formas, guardar y lo que es más importante, tener a mano, aquello que previamente hemos seleccionado para cuando lo necesitemos. Un buen ejemplo de lo que estamos diciendo es el post de hoy, en el que vamos a intentar aclarar algunos conceptos básicos en relación a los fármacos biosimilares, algunos de los cuales están llamando ya a nuestra puerta. Así que, para la ocasión hemos tirado del archivo tuitero y con este magnífica revisión de Belén Calabozo como guía, os presentamos lo que pretende ser un didáctico juego de preguntas y respuestas sobre este polémico asunto…
¿Qué es un biosimilar? Los biosimilares son medicamentos biológicos similares a otros ya existentes (denominados de referencia o innovadores). Se entiende por medicamento biológico el que contiene uno o más principios activos sintetizados o derivados de una fuente biológica (fluidos, tejidos humanos o animales, microorganismos) producidos por diferentes técnicas.
¿Cómo se obtiene un biosimilar? Directamente por el organismo vivo (p.ej. factores de coagulación) o por biosíntesis en células vegetales o animales, bacterias, levaduras y virus mediante técnicas de biología molecular o biotecnológicas que implican la manipulación del material genético (medicamentos biotecnológicos).
¿Qué exige la EMA a los medicamentos biológicos? En la Guideline on similar biological medicinal products se recoge que debe establecerse la comparabilidad de dos fármacos (biosimilares e innovador o dos biológicos entre sí):
– Demostrando mediante datos preclínicos que la calidad de ambos productos es similar. Para ello se aportarán datos comparativos de la caracterización molecular y biológica (estructura tridimensional, actividad biológica, etc) de los productos comparados.
– Mediante una evaluación clínica mediante los ensayos clínicos comparativos que servirán para garantizar que la seguridad y eficacia del biosimilar es adecuada.
Los criterios de comparabilidad exigidos por la EMA a los biosimilares son superiores a los solicitados a los productos de referencia. Así, a aquéllos se le exigen estudios de no inferioridad frente a estos, mientras que a los innovadores sólo se le exigen estudios frente a placebo.
¿Debe preocuparnos la inmunogenicidad? La capacidad para inducir inmunogenicidad es inherente a cualquier medicamento biológico y depende de numerosos factores, como la genética del individuo, el tipo de enfemerdad, el proceso de producción, el tipo de molécula, etc. Este aspecto compromete tanto la seguridad como a la eficacia, razón por la cual la EMA dispone de directrices específicas para las proteínas terapéuticas y los anticuerpos monoclonales. En el caso de los biosimilares, la normativa contempla que la inmunogenicidad del biosimilar y del producto de referencia debe ser comparada tanto in vitro como en ensayos clínicos ad hoc.
¿Y la farmacovigilancia? De acuerdo con la legislación vigente, todos los medicamentos biológicos autorizados deberán incluirse en la lista de medicamentos de seguimiento adicional. Así mismo, se incluirá un triángulo negro durante los primeros 5 años en la ficha técnica y cartonaje. Por su parte, la Directiva 2001/83/CE, requiere que se utilice siempre la marca comercial, con el fin de asegurar una identificación inequívoca.
¿Se pueden extrapolar las indicaciones? En ciertos casos, tanto EMA como FDA permiten extrapolar al biosimilar algunas o todas las indicaciones del medicamento de referencia sin necesidad de llevar a cabo ensayos clínicos. Esto requiere una adecuada justificación científica y un ejercicio de comparabilidad, aspectos ambos recogidos en las guías específicas para cada biosimilar o en el EPAR del biosimilar en cuestión.
¿Son intercambiables en España? La EMA no hace referencia a este asunto y lo deja en manos de cada país. En España, es de aplicación la orden SCO/2874/2007, que incluye a los medicamentos biológicos y se refiere a la sustitución por el farmacéutico comunitario. No obstante, en el ámbito hospitalario, se abren nuevas posibilidades al amparo del artículo 82 de la Ley de garantías y uso racional de los medicamentos y productos sanitarios, ya que es posible un mayor seguimiento y monitorización de los tratamientos por lo que el intercambio puede realizarse con mayores garantías. Por ello, cada centro decidirá acerca de los criterios de utilización de biosimilares, al igual que del resto de fármacos de ámbito hospitalario, cuando no exista una comisión específica para la selección de medicamentos a nivel nacional o autonómico.
¿Por qué existen los biosimilares? Porque las patentes de los medicamentos biológicos, responsables de una parte importante del gasto farmacéutico, también caduca lo que brinda una oportunidad para disminuir los costes. En España los biosimilares están incluidos en el sistema de precios de referencia (artículo 93 de la citada Ley de garantías) por lo que el Ministerio podrá determinar una reducción de los precios que podría alcanzar el 30%.
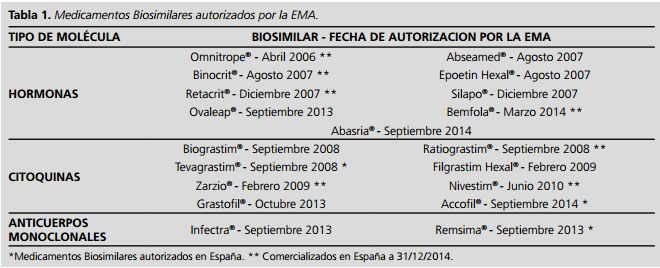
¿Existen biosimilares autorizados en Europa? Nada menos que 19. Y uno comercializado en España desde 2007: somatotropina. En próximas fechas está prevista la comercialización de dos biosimilares de insulina glargina denominados respectivamente Abasaglar (Eli Lilly) y Toujeo (Sanofi Aventis). En EE. UU. hace meses se autorizó el primer biosimilar de filgrastim (Zarxio, Sandoz) y se ha creado el Purple book para este tipo de medicamentos, de forma análoga al Orange book de los genéricos.
Original en el siguiente artículo.
Comentario: que los biosimilares van en serio se deduce de noticias como la próxima presentación de la nueva patronal del sector, denominada Biosim o los posicionamientos de algunas sociedades científicas como la Sociedad Española de Reumatología o, recientemente, la Sociedad Española de Farmacia Hospitalaria tras los cuales se vislumbra una nueva lucha por el poder de sustitución. No es objetivo del presente post entrar en este tipo de disquisiciones, sino sólo hacer una primera aproximación a un tema que, como decíamos al principio, va a ser polémico y estará en el origen de no pocas discusiones, por cierto, en ambos niveles asistenciales. Éstas serán bienvenidas si con ellas se logra un uso seguro y eficiente de un nuevo grupo de medicamentos que de forma inminente inundarán el mercado desde diversos flancos. Ojalá que la confrontación de los argumentos científico-técnicos esgrimidos por tirios y troyanos sea, lejos de los consabidos conflictos de intereses, el prolegómeno a la toma de decisiones centradas en el beneficio de los pacientes y, de rebote, alivien las depauperadas arcas públicas. Aunque confesamos que ya no nos quedan dedos que chupar…
Te felicito porque es un post corto, sencillo y ameno que explica muy claramente qué es un biosimilar y en qué situación legal nos encontramos ahora.
Con los biosimilares veo venir problemas similares que con los medicamentos genéricos, tanto por la presión de la industria como por la presión del hospital para ir a por el medicamento más barato, dificultando la libertad de prescripción. Y, en medio, la desconfianza de los pacientes y los continuos cambios de aspecto del envase con el medicamento…
Me gustaMe gusta
Hola Sophie:
Podríamos simplificar diciendo que los biosimilares son los «genéricos» de los medicamentos biotecnológicos, pero eso no es cierto y situaría el tema de la sustitución y el lío de los múltiples cambios en un terreno resbaladizo: los biosimilares, no son -salvo causa de fuerza mayor- intercambiables por lo que, decidido el que se pone, se debería administrar siempre el mismo.
Ni que decir tiene que la guerra se traslada al ámbito de la decisión de cuál tenemos en el hospital (o en el área, o en el distrito…) porque eso determinará todo el proceso ulterior. Por eso mi alusión a las «capillitas» en el comentario. Como se puede comprobar, este es un terreno complejo en el que la argumentación científico-técnica se hila muy fino. Es el momento de la discusión de altura y de dejar otros asuntos de lado, aunque es tantísimo el dinero que se mueve (pasado mañana se comercializa en España la primera insulina biosimilar y las insulinas son la principal causa del gasto farmacéutico, nada menos que en la diabetes) que la polémica está asegurada. A ver cómo se desarrollan los acontecimientos…
Un saludo y gracias por tu comentario.
CARLOS
Me gustaMe gusta
[…] – Primeros apuntes sobre biosimilares […]
Me gustaMe gusta
Tengo entendido que existe diferencias entre los biosimilares y los genericos, donde el primero podriamos decir que es exactamente igual a la molecula principal mientras que los genericos son copias de las moleculas donde la biodisponibilidad y biocinetica son diferentes a la molecula principal.
Me gustaMe gusta
Hola, María Isabel:
Existen muchas diferencias. Los genéricos se refieren a fármacos con estructura química definida (como por ejemplo, el ibuprofeno) mientras que los biosimilares se refieren a los productos de origen biológico (como la insulina). A los primeros se les puede aplicar el concepto de bioequivalencia y a los biosimilares son, eso, similares, como se explica en el post.
Gracias por tu comentario.
CARLOS
Me gustaMe gusta
[…] – Primeros apuntes sobre biosimilares […]
Me gustaMe gusta